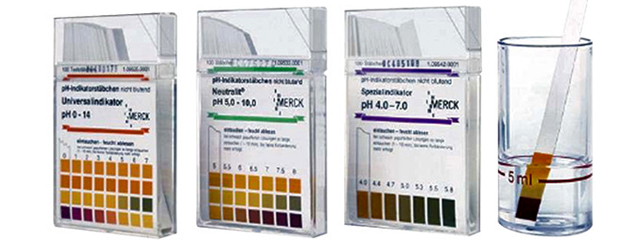
Die pH-Indikatorstäbchen gibt es mit unterschiedlichen Messbereichen. Die Messung ist in schwach gefärbten und trüben Flüssigkeiten möglich, da die Stäbchen ohne Veränderung der Farbeinstellung kurz mit destilliertem Wasser abgespült werden können. © MERCK: Universal 0-14 (in 1,0 pH-Werten); Neutralit 5,0-10,0 (in 0,5 pH-Werten); Spezialindikator 4,0-7,0 (in kleineren pH-Werten)
|

|
|

Kartoffeln, Kräuter, Obst, Dinkelbrot, etc. Möglichst wenig zu sich nehmen sollte man „saure Nahrungsmittel“ wie Fleisch (wenn, dann höchstens etwas Geflügel und Lamm), Salzwasserfische, Roggenmehl, Nudeln, Eier, Süßigkeiten, Limonaden, Cola, Mineralwasser mit Kohlensäure, Kaffee, schwarzer Tee, Fette, Alkohol u. a. Vorsichtiger Umgang auch mit gesäuerten Milchprodukten (Joghurt etc.). Als Faustregel gilt: 75 % der Ernährung sollte immer aus basischen Lebensmitteln bestehen.
Bei Nierenproblemen oder anhaltender Übersäuerung empfiehlt der Arzt ein Bicarbonat-Medikament. Da Bicarbonat von der Magensäure zerstört wird, sollen die Präparate „magensaftresistent“ sein, damit sie sich erst im Dünndarm auflösen.
Die Regulierung des Säure-Basen-Haushalts
Bis zu einem gewissen Grad können körpereigene Puffersysteme die Wasserstoff-Ionen aufnehmen oder freisetzen und verhindern damit eine Verschiebung des pH-Wertes:
Der Bicarbonat-Puffer (Salze der Kohlensäure) mit ca. 52% Kapazität und der Hämoglobin-Puffer (eisenhaltiger Proteinkomplex, der in den roten Blutkörperchen den Sauerstoff bindet) mit ca. 31% des Blutes sind die größten Puffer im Körper und stabilisiert den pH-Wert.
Die Ausatmung von Kohlendioxid durch die Lunge (pulmonale Regulation).
Die Ausscheidung von H+-Ionen bewerkstelligt die Niere (renale Regulation).
Die Leber ist für die Glucoseneubildung und damit dem Abbau von Laktat zuständig.
Der Skelettmuskel sorgt für den Abbau von Laktat.
Im Knochen befinden sich basische Calciumsalze als Gerüstsubstanz.
1.10.2012 ■ MARITA GRABOW |
|
|
Substanz
|
pH-Wert
|
Art
|
|
Batteriesäure
|
<0
|
sauer
|
|
Magensäure (nüchterner
Magen)
|
1,0
– 1,5
|
|
Zitronensaft
|
2,4
|
|
Cola
|
2,0
–
3,0
|
|
Essig
|
2,5
|
|
Fruchtsaft der
Schattenmorelle
|
2,7
|
|
Orangen- und
Apfelsaft
|
3,5
|
|
Wein
|
4,0
|
|
Saure Milch
|
4,5
|
|
Bier
|
4,5
–
5,0
|
|
Saurer Regen
|
<
5,0
|
|
Kaffee
|
5,0
|
|
Tee
|
5,5
|
|
Hautoberfläche
des Menschen
|
5,5
|
|
Regen (natürlicher
Niederschlag)
|
5,6
|
|
Mineralwasser
|
6,0
|
|
Milch
|
6,5
|
|
Wasser (je nach
Härte)
|
6,0
–
8,5
|
sauer
bis basisch
|
|
Menschlicher
Speichel
|
6,5
–
7,4
|
|
Reines Wasser
|
7,0
|
neutral
|
|
Blut
|
7,4
|
basisch (alkalisch)
|
|
Meerwasser
|
7,5
–
8,4
|
|
Pankreassaft
(Darmsaft)
|
8,3
|
|
Seife
|
9,0
–
10,0
|
|
Haushalts-Ammoniak
|
11,5
|
|
Bleichmittel
|
12,5
|
|
Beton
|
12,6
|
|
Natronlauge
|
13,5
–
14
|
■ WIKIPEDIA↑
– AUTOREN↑
(Lizenz↑)
Wenn Ihnen der Artikel gefiel, würden wir uns über einen Beitrag zu unserer Arbeit sehr freuen. Danke.
|
|
1
2
|
|